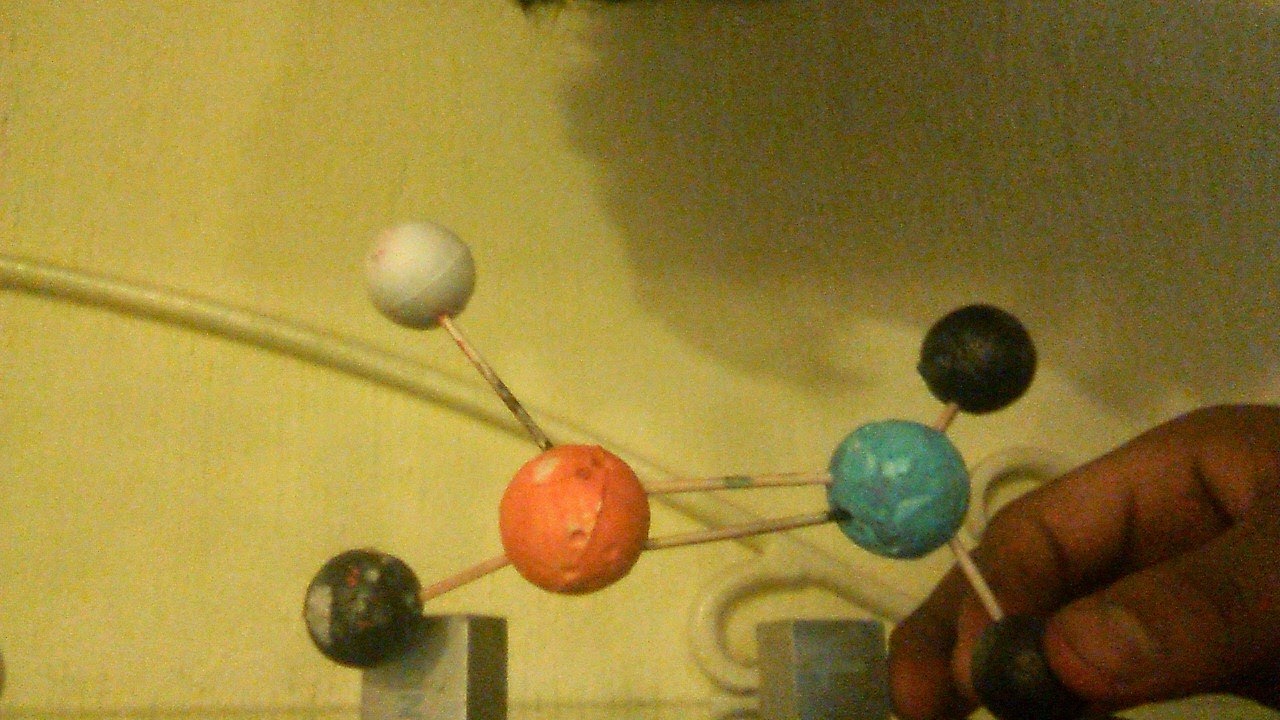QUÍMICA ORGÁNICA
este blog es basado en variados proyectos de la materia quimica organica por las alumnas de 2do B equipo 5 alumnas: Marisol Mixcoatl Aguilar nelly Andrea Ireri Paola Rosio cierra
Datos personales
sábado, 16 de agosto de 2014
miércoles, 23 de julio de 2014
domingo, 13 de julio de 2014
martes, 10 de junio de 2014
moleculas
Equipo de clase: Sergio Omar flores, Marisol Mixcoatl A.,
Moléculas
O
P-C S-C
P-O
S-O
P-C
Azufré- oxigeno, forma tetraédrica, hibridación sp3
Azufre-carbono forma trigonal plana, hibridación sp2
P-C
Fosforo-carbono, forma tetraédrica, hibridación sp3
fosforo-carbono forma trigonal plana, hibridación sp2
fosforo-carbono, unión en x,y,z, forma lineal, hibridación sp
P-O
lunes, 9 de junio de 2014
tipos de enlaces cuadro comparativo (marisol Mixcoatl Aguilar)
|
Tipo
de Enlace
|
Como
se constituye
|
Características
|
Dibujo:
|
||||
|
Iónico
|
Fuerza de
atracción de iones con cargas opuestas
iones
positivos y negativo
Forman
compuestos con propiedades diferentes
Fuerza de atracción
entre partículas con cargas opuestas.
|
Iones (+) =
catión
Iones(-) =
anión
Son enlaces
fuertes
|
 |
||||
|
Covalente
|
las
fuerzas que mantienen unidos entre sí los átomos no metálicos.
los
átomos no metálicos no pueden cederse electrones entre sí para formar iones de
signo opuesto.
|
Buscan su
estabilidad compartiendo electrones y completar su ultimo nivel de energía o
su octeto.
Se represantan en linea
|
 |
||||
|
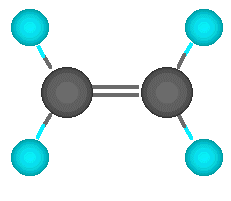
Simple
|
Cada átomo
aporta un electrón al enlace, se comparte un par de electrones
entre dos átomos.
|
se comparten 2 electrones de la capa de
valencia.
Son polares
|
 |
||||
|
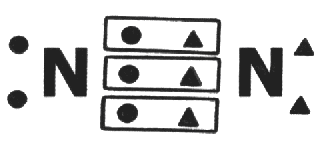
Doble
y triple
|
·
Cada átomo
aporta dos electrones al enlace se comparten dos pares de
electrones entre dos átomos.
·
Cada átomo
aporta tres electrones al enlace, es decir, se comparten tres pares de
electrones entre dos átomos.
|
·
Enlace
doble: se comparten cuatro electrones, en dos pares, de la capa de valencia.
Enlace
triple: se comparten 6 electrones de la capa de valencia en 3 pares.
|
·
|
Suscribirse a:
Comentarios (Atom)
BIOMOLÉCULAS

grupos funcionales

estereoquímica

química orgánica

química orgánica

por: Nelly Andrea
cuadro comparativo

ireri paola
enlaces covalentes

química orgánica

química orgánica

mapa conceptual de qúímica orgánica